要点:
中国首个XBB疫苗最早于2023年5月17日宣布批准进行临床试验,至批准上市仅22天。
获批新闻中提及的对各变异株中和抗体滴度高、对XBB有效性93%等,均无可核实的文献报道。从批准临床试验至批准仅间隔22天来看,几乎不可能在临床试验中获得任何上述数据
该疫苗突变株版本无法查到正式发表的临床试验论文,原始株疫苗仅一二期临床试验发表一篇论文。参考该论文,该疫苗诱导抗体水平与中国最早的新冠重组蛋白疫苗类似
XBB疫苗如今描述的佐剂与以往原始株一二期临床试验中描述的佐剂不同,如属实应归属于完全不同的疫苗,安全性等无法参考过往原始株疫苗数据。
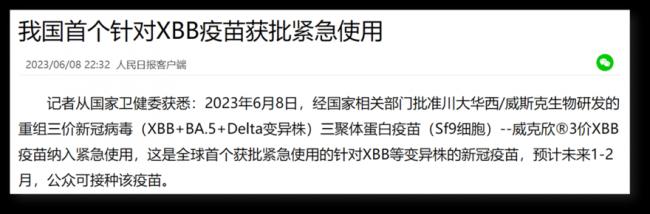
6月8号,全世界第一个XBB疫苗获批。
经常有人问我XX疫苗怎么样。如果这里的XX是国产疫苗,特别是2022年底一次批准的那一拨多到连名字都已经记不住的疫苗,我一般都只会说能找到的信息比较少。
不信的话你可以自己去找一下。那些疫苗临床试验的论文,审核时的有效性、安全性数据分析,上市后到现在的安全性跟踪,保守的说,属于隐藏比较深,不太好找到;不保守的说,有的疫苗就是根本找不到。
任何一个疫苗,我们只能根据能找到的信息去核实,去分析。那这次批准的XBB疫苗我们能找到什么信息呢?除了6月8号获批的信息,之前的新闻是5月17号获批进入临床试验:
5月17号还是全球首个进入临床试验的XBB疫苗,6月8号摇身一变就成了全球首个获得(紧急使用)批准的XBB疫苗。注意,都是2023年。
5月17号到6月8号,中间有几天呢?喜欢动手的可以自己掰手指头数,两只手一起用只要掰两轮多一点就行了,22天。喜欢动嘴的,可以问问Siri,再不放心,能问问google、百度,要赶时髦,还能问问ChatGPT、文心一龙。应该都会告诉你是22天。
22天,应该创了世界纪录。如果临床试验包括了基础免疫,采用新冠疫苗里较常见的间隔28天打两针,那么都来不及让受试者打上第二针疫苗。
当然,现在绝大多数人都完成了基础免疫,因此,获批临床试验可能只是做增强针这一针的试验。对的,就是这个获批临床试验的事儿,都没有信息显示具体是什么类型的临床试验,保密程度之高,令人佩服。
我也去看了一下,全球最早进入临床试验的新冠疫苗,Moderna的mRNA疫苗,给一期临床试验招募的45人打完第一针,是2020年的3月16日到2020年的4月14日:

用了29天。所以,我也不太确定批准进行临床试验22天后,能够招募到多少人完成接种,完成接种后能跟踪多久。但据报道,已经有临床试验数据显示接种这款疫苗14天后,针对XBB株系的保护效力达到了93.23%。

获批临床试验只有22天,能做出有效性数据,这都不是世界记录,是世界奇迹了。不过既然获批临床才22天,而有效性跟踪是接种14天后,那么就是跟踪了第15天到22天,顶多7天的有效性?淘宝退货期限都不止7天吧?以前说多快好省地建设社会主义,这款XBB疫苗至少把“快”和“省”给满足了。
挺有意思的是,这个XBB疫苗在获批临床时就说针对各种变异株都能诱导出很高的中和抗体,也不知道是从谁身上测的抗体:

如今获批后的新闻直接把对一票变异株有较高中和抗体的内容复制黏贴了一下,只是前面加上“临床数据显示”:

只是,什么水平算高水平?高考还得有一本线、二本线呢,这抗体高水平是啥?抗体中的985,211?又是多少人以及接种多少天后显示出的高水平呢?
甭管多高的水平,这个Sf9细胞生产的重组蛋白疫苗,我在pubmed上只找到了一篇临床试验论文,还是原始株版本的一二期临床试验结果:

根据这篇论文,该疫苗的免疫原性和中国最早上市的重组蛋白疫苗差不多,优势在于采用了更短的接种间隔,如果同样以三针做基础免疫可以在一个月内完成(另一个需两个月):

而且和中国最早批准的重组蛋白疫苗智飞类似,这种Sf细胞里生产的疫苗,基础免疫用两针的效果远远不如用三针。一期试验部分,每隔14天打一针的三针组,与隔28天打了两针的比,同是成年人高剂量组,同样接种完最后一针28天后测针对原始株的中和抗体滴度,三针组是102.9,两针组只有2.3。
二期试验两针组改成了隔21天打第二针,但高剂量组中和抗体滴度还是只有3.6,远低于三针组的102.6。两针组抗体转阳率也低,结合抗体转阳率只有69%,中和抗体转阳率仅49%。
打三针才能诱导出显著的中和抗体,意味着这个疫苗从技术平台上来说免疫原性不高。论文披露的一些信息也能在原理上做解释,例如,该疫苗是采用S蛋白的RBD部分做抗原,这与国内最早批准的重组蛋白智飞类似,无非是智飞用CHO细胞生产,该疫苗用Sf细胞生产。目前看来,RBD短抗原的设计,免疫原性不如全长S蛋白是普遍规律,如BioNTech用同一个mRNA疫苗平台做过这两种设计,最后全长S蛋白无论安全性还是免疫原性都显著胜出。
另外从新闻报道看,该疫苗和智飞一样是采用多聚体稳定抗原,也都使用了氢氧化铝这一免疫原性不强的传统佐剂。因此,表现类似符合预期。
这种情况下,没有什么强有力的数据,突然把这个疫苗说得特别有效,也蛮搞笑的。毕竟,后来一些研究显示灭活疫苗基础上混打智飞,免疫反应没比灭活疫苗同源加强高多少。技术平台决定的免疫原性强弱,不是简单换个抗原就能改变的。否则把灭活疫苗做成XBB版本,还能吊打mRNA疫苗或是用高效佐剂的重组蛋白疫苗不成?
当然,也有可能当下获批的XBB疫苗已经彻底改了技术。这倒真有迹可循,如今网上报道该疫苗都称是基于角鲨烯的水包油乳液佐剂,后者应是和AS03、MF59等类似的佐剂(这两个都用于一些流感疫苗)。不过那样的话,就成了完全不同的疫苗技术平台,岂非一篇相关论文都没有了?
如今新冠不是乙类乙管了吗?根据一些专家们的说法,新冠和感冒差不多,二阳大部分都很轻微等等。既如此,又为什么继续用紧急使用授权去批准新冠疫苗呢?紧急使用授权难道不该是紧急状态下才需要的吗?
话说回来,批准进行临床试验22天就给予紧急使用授权,感觉真的很紧急,大概是类似外星人入侵般火烧眉毛似的紧急。可据报道,这个获得紧急使用授权的XBB疫苗要1-2个月后才能让公众接种。所以,到底是十万火急,还是不急呢?
反正吧,22天能从批准临床试验变成批准上市,算是创了世界纪录。也不知这个记录还有没有可能被打破,毕竟要更快,大概只能是药企去向药监局申请开展临床试验,药监局回复,做毛个试验,立刻上市,赶紧赚钱去。
咦,等等,好像中成药就……呃,那22天还真不是记录。清肺排毒汤剂从发明人将处方公布在朋友圈的2020年1月22日到获得卫健委推荐的2月6号,仅仅隔了15天。看来,让国产疫苗赶上博大精深的中成药,药企和药监局还得再加把劲啊。
(注:本文墙内互联网已经被删除,本文经由“自由微信”平台获取。)